随着工业的发展,重金属废水排放量不断增加,我国各大江河湖库均受到不同程度的重金属污染。辽河、松花江、黄河、西南诸河、海河和长江等水系共有40个断面出现铬、铅、汞等重金属超标现象。铬在自然界中有3种
1 实验部分
1.1 主要仪器、试剂及原料
箱式马弗炉(SX2-4-10,华港通科技有限公司),ICP-MS(XSEKIES2,Thermo Fisher Scientific)、紫外可见分光光度计(UV-1800,SHIMADZU)、环境扫描电子显微镜(Quanta 200FEG,FEI company)、气体吸附分析仪(ASAP 2010,Micromeritics) 、pH 计(pH211,HANNA)、分析天平(PL203,METTLER TOLEDO)、恒温振荡器(SHA-C,常州国华电器有限公司) 。氮气(>99.999%)、二氧化碳(>90%) 购自北京康思惠尔科技有限公司; 硫酸(北京化工厂)、磷酸(西陇化工股份有限公司)、二苯基碳酰二肼(国药集团化学试剂有限公司)、重铬酸钾(国药集团化学试剂有限公司)、丙酮(北京化工厂)、氯化钠(国药集团化学试剂有限公司)、盐酸(北京化工厂)、氢氧化钠(国药集团化学试剂有限公司) 等试剂都是分析纯; 布料为纯棉布。
1.2 实验方法
1.2.1 活性炭纤维的制备
将棉布裁剪成5 cm×2.5 cm大小,用蒸馏水洗净后放入80℃烘箱烘干。以水料比(体积∶质量)=10∶1 加入80% 的磷酸中搅拌溶解5 min,室温下浸泡1 h 后取出,洗净至pH 恒定后放入80℃烘箱,24 h 后取出。然后以水料比(V∶w)=10∶1 将其置于7. 5% 的磷酸氢二胺溶液中,浸渍3 h 后取出,沥干溶液,放入80℃烘箱中烘干制得预处理棉布(pretreatedcotton woven,PCW) 。将PCW 放入箱式马弗炉,在0.6 L/min 的氮气氛围下从25℃以5 ℃/min的加热速度加热至700℃并保持30 min,然后以10℃/min 的加热速度加热至800℃,在0.5 L/min二氧化碳气体氛围下保持30 min 后停止加热,氮气氛围下待温度降至300℃取出,冷却至室温后将样品浸泡到蒸馏水中震荡过夜,洗至pH 接近6,放入80℃烘箱烘干,制得ACF。
1.2.2 水样的配制
准确称取2.096 g K2Cr2O7溶于1000 mL去离子水中,配成1 000 mg/LCr(VI) 溶液,在实验中稀释成1.0 mg/L 的模拟废水。
1.2.3 分析方法
pHpzc采用以下方法测定: 将0.15 g ACF 分别置于50 mL 不同pH初始(pH=1 ~ 12) 的0.01 mol/L NaCl 溶液中,其中pH初始由0.1 mol/L HCl 或0.1mol/L NaOH 溶液进行调节,室温下震荡48 h 后测量溶液的pH最终,并对pH初始绘制曲线,求出pH最终=pH初始的点,即为pHpzc。采用N2吸附法测定ACF的比表面积、孔容和孔径。通过环境扫描电子显微镜观察ACF 的表面形貌。六价铬浓度采用二苯基碳酰二肼紫外分光光度法测定。
1.2.4 吸附实验
取100 mL 模拟水样于250 mL 锥形瓶中,加入一定量的ACF,置于200 r/min 的摇床中震荡一定时间后,取样过滤,测定Cr(VI) 的浓度。根据式(1) 计算ACF 对Cr(VI) 的去除率R(%) :
![]()
式中: C0、Ct分别为溶液中Cr(VI) 的初始浓度(mg/L) 和吸附时间为t 时的浓度(mg/L) 。
2 结果和讨论
2.1 活性炭纤维的表面分析
图1 为ACF 的表面形貌,可以看出,制得的活性炭纤维呈纤维状(纤维横截面为椭圆,其长轴为11.7μm,短轴为2.6 μm),具有一定的沟槽和凹坑,多孔结构可为吸附质提供足够的吸附空间,有利于吸附反应的进行。ACF 的pHpzc=5.93,其表面积为818.75m2/g,平均孔径为1.93 nm,属于微孔结构,微孔孔容所占比例为58. 8%。元素分析结果显示,碳含量为85.08%,说明其碳化程度比较充分。

2.2 接触时间的影响
Cr(VI) 初始浓度为1.0 mg/L,ACF 投加量为0.5 g/L,吸附温度293 K 时,Cr(VI) 去除率随接触时间的变化情况见图2。
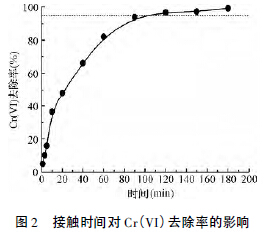
由图可知,吸附初期吸附速度较快,前20 分钟Cr(VI) 去除率由0 增至48.2%,20 ~120 min Cr-(VI) 去除率增加变缓,120 min 时Cr(VI) 去除率为96.6%,之后溶液中Cr(VI) 去除率变化不大。这是由于吸附初期大量的吸附位点对Cr(VI) 有强烈的吸引,随着时间的延长Cr(VI) 去除率随时间的变化趋缓,并最终达到吸附平衡。为保证吸附达到平衡,后续实验选择吸附时间为180 min。
2.3 ACF 投加量的影响
Cr(VI) 初始浓度为1.0 mg/L,ACF 投加量分别为0、0.01、0.05、0.10、0.10、0.20、0.30、0.40、0.50和0.60 g ACF/L 废水,吸附温度293 K,吸附时间为180 min,考察ACF 投加量对Cr(VI) 去除的影响,结果见图3。

由图可见,当剂量由0 增至0.40 g/L 时,去除率很快上升,由0 上升至94.39%,当投加量达到0. 50 g/L,去除率为98.33%。之后,再增加吸附剂的投加量,去除率变化不明显。这是因为ACF 剂量增加,吸附剂的活性点位增加,吸附表面积增大,对Cr(VI) 的吸附能力增强,导致Cr(VI) 增加; 当ACF投加量继续加大时,其对Cr(VI) 的吸附趋于饱和,故Cr(VI) 去除率变化趋缓。若以GB5749-2006 中限制值(< 0.05 mg/L) 为控制指标选定最小投加量,则ACF 对Cr(VI) 的去除率应在95% 以上可以达标,所以后续实验选择的投加量为0.50 g/L。
2.4 pH 的影响
Cr(VI) 初始浓度1.0 mg/L,ACF 投加量为0.5g/L,吸附温度293 K,吸附时间为180 min 时测定体系pH 对Cr(VI) 去除的影响,结果见图4。
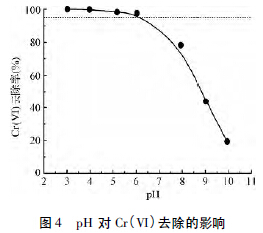
结果表明,酸性范围内pH 对Cr(VI) 的去除率影响较小,碱性范围内pH 对Cr(VI) 的去除率影响较大。当pH 由3 增至6 时,Cr(VI) 的去除率由100%缓慢降至97.6%; 当pH 由6 增至10 时,Cr(VI) 去除率由97.6% 迅速下降为19.3%。这是由于在低浓度下,Cr(VI) 的存在形式为HCrO4 和CrO42-且相对含量与pH 有关,当pH 在3 ~6 时,Cr(VI) 主要以HCrO4-形式存在,当pH>6 时,Cr(VI) 的主要存在形式为CrO42-。当体系pH 小于ACF 的等电位点(pHZPC=5.93) 时,ACF 表面为正电荷,溶液中有大量的H +,吸附剂表面官能团质子化,较强的静电吸引力和较弱的静电斥力有利于HCrO4-的吸附,有利于对Cr(VI) 的吸附。当体系pH 大于pHZPC时,ACF 表现为负电性,随着pH 的升高,ACF 与CrO42-静电引力吸附作用减弱,表面排斥力增强,加上与水中OH-的竞争吸附,导致ACF对Cr(VI) 吸附去除率的下降。
当体系的pH 范围为3 ~6 时,Cr(VI) 的去除率均大于95%,由于实验配水的pH 为5.86,小于pHZPC,在后续的实验中未对水样的pH 进行调节。
2.5 吸附等温线
在转速200 r/min 条件下,考察Cr(VI) 在293K、298 K、303 K、308 K 和313 K 下的吸附等温线(见图5) 。结果表明,ACF 对Cr(VI) 的吸附容量随平衡浓度的增大而增大,在293 K 时,Cr(VI) 平衡浓度由0.017 mg/L 增至0.930 mg/L 时,ACF 的吸附容量由1.986 mg/g 增加到7.167 mg/g。在293 K到313 K 范围内,吸附容量随温度升高而增大,说明ACF 对Cr(VI) 的吸附为吸热反应。

采用Langmuir、Freundlich 和Redlich-Peterson 3种等温吸附模型对数据进行拟合。Langmuir 等温吸附模型表示同质表面的单层吸附,其吸附方程可表示为:
![]()
式中: qe为平衡吸附量(mg/g) ; qm是吸附容量(mg/g) ; Kb是Langmuir 吸附热力学常数(L/mg),表示吸附质与吸附剂之间的亲和力; Ce为平衡浓度(mg/L) 。Freundlich 等温吸附模型以可逆吸附为假设,表示吸附质表面的异质多层吸附,其吸附方程可表示为:
![]()
式中: qe为平衡吸附量(mg/g) ; KF是Freundlich 平衡常数(L/mg),与吸附容量有关; Ce为平衡浓度(mg/L) ; n 是经验常数。Redlich-Pedterson 吸附等温式将Langmuir 和Freundlich 等温方程组合到一个公式中,能在很宽泛的浓度范围内描述重金属在吸附剂表面的吸附平衡状态,其吸附方程可表示为:
![]()
式中: qe为平衡吸附量(mg/g) ; A(L/g),g(0<g<1)和B(L/mg) 都是Redlich-Pedterson 吸附热力学常数。
表1为3 种吸附等温模型的拟合结果,由相关系数可知,Freundlich 等温吸附模型的拟合结果最好,意味着多相的铬覆盖在ACF上。KF随着温度的升高而增大,说明吸附容量随着温度的升高而增大。n>2,说明ACF 对Cr(VI) 的吸附为易吸附过程。
表1 3 种热力学模型拟合结果

2.6 热力学分析
吸附过程中吉布斯自由能的变化ΔG 依照下式计算:
ΔG=-RTlnKL
式中: KL是热力学平衡常数,其值可通过ln(qe/Ce)对qe作图,外推至qe=0 得到。图6 为不同温度下ln(qe/Ce) 随qe的变化曲线,结果表明,当温度为293 K、298 K、303 K、308 K、313 K 时,ΔG 分别为-3.654、-4.620、-5.314、-5.929 和-6.240 kJ/mol,其绝对值随温度的升高而增大,说明升温有利于吸附反应的进行。ΔG<0,说明吸附过程为自发过程,由于-ΔG<20 kJ/mol,说明此过程为物理吸附。ΔG 也涉及到恒定温度下的熵变和吸附热: ΔG=ΔH -TΔS。结合两方程,可得:
![]()
以lnK 对1/T 作图,由直线的斜率和截距计算得出吸附反应的表现焓变ΔH 和熵变ΔS 分别为34.41kJ/mol 和130.6 J/(mol·K) 。ΔH> 0,说明该吸附过程吸热,ΔS> 0,说明吸附过程增加了吸附剂与溶液间的混乱程度。
2.7 吸附动力学
为研究ACF 对Cr(VI) 的吸附动力学,分别用准一级反应动力学方程、准二级反应动力学方程、Bangham 和双常数方程对ACF 净化吸附Cr(VI) 的数据进行拟合。
准一级方程可表示为:
ln(qe-qt)=lnqe-k1t
其中,qe为平衡吸附量(mg/g) ; qt为反应时间t 时ACF 对Cr(VI) 的吸附量(mg/g) ; k1为准一级速率常数(min -1);准二级方程可表示为:
![]()
式中: qe为平衡吸附量(mg/g); qt为反应时间t 时ACF 对Cr(VI) 的吸附量(mg/g) ; k2为准二级速率常数[g/(min·mg) ]。
Bangham 动力学模型的线性方程为:
![]()
式中: C0为Cr(VI) 初始浓度(mg/L) ; m 为ACF 的添加量(mg/L),kb和a(<1) 为Bangham 动力学常数,可从线性方程的斜率和截距求得; V 为水样体积(mL) 。
双常数方程的线性形式为:
lnqt=lna+Kslnt
式中: KS为吸附速率常数; a 为常数。
表2 为4 种吸附动力学模型的拟合结果,可以看出,准二级方程拟合的相关系数最高(R2=0. 9969),说明Cr(VI) 在ACF 表面的吸附动力学符合准二级方程。具体参见http://www.dowater.com更多相关技术文档。
表2 吸附动力学曲线拟合结果

3 结论
采用废弃棉布制备的活性炭纤维可用于吸附处理Cr(VI) 微污染水,当Cr(VI) 初始浓度为1.0 mg/L,ACF 剂量为0.5 g/L 时,吸附180 min 后,Cr(VI)去除率可达95%以上。Cr(VI) 在ACF 表面的吸附可用Freundlich 吸附等温模型描述,吸附可自发进行,ACF 对水中Cr(VI) 的吸附动力学符合准二级动力学方程。以废弃棉布为前驱体材料制备ACF,可降低ACF 的生产成本,同时为废弃棉布的资源化利用提供了新的途径。